صنعت داروسازی در مسیر بهرهوری
اسفندیار جهانگرد، اقتصاددان و استاد دانشگاه علامهطباطبایی
نوآوری در داروهای جدید محدود است به دانش بشر درباره سلولها و مولکولهایی (هدفها) که قادر به کنترل آنها برای درمان بیماری است. هزینه کشف داروهای جدید افزایش یافته زیرا آسانترین اهداف ایدهای است که قبلا انتخاب شدهاند. فناوریهای نوظهور در تلاقی هوش مصنوعی و ژنومیک پتانسیل باز کردن دورهای جدید از فراوانی هدفهای درمانی را دارند که ممکن است روند نزولی دهههای اخیر در بهرهوری تحقیق و توسعه را بازگردانند. اگر این وعده محقق شود، یکی از مهمترین تاثیرات هوش مصنوعی در دهههای آینده خواهد بود.
قانون اروم «Eroom»
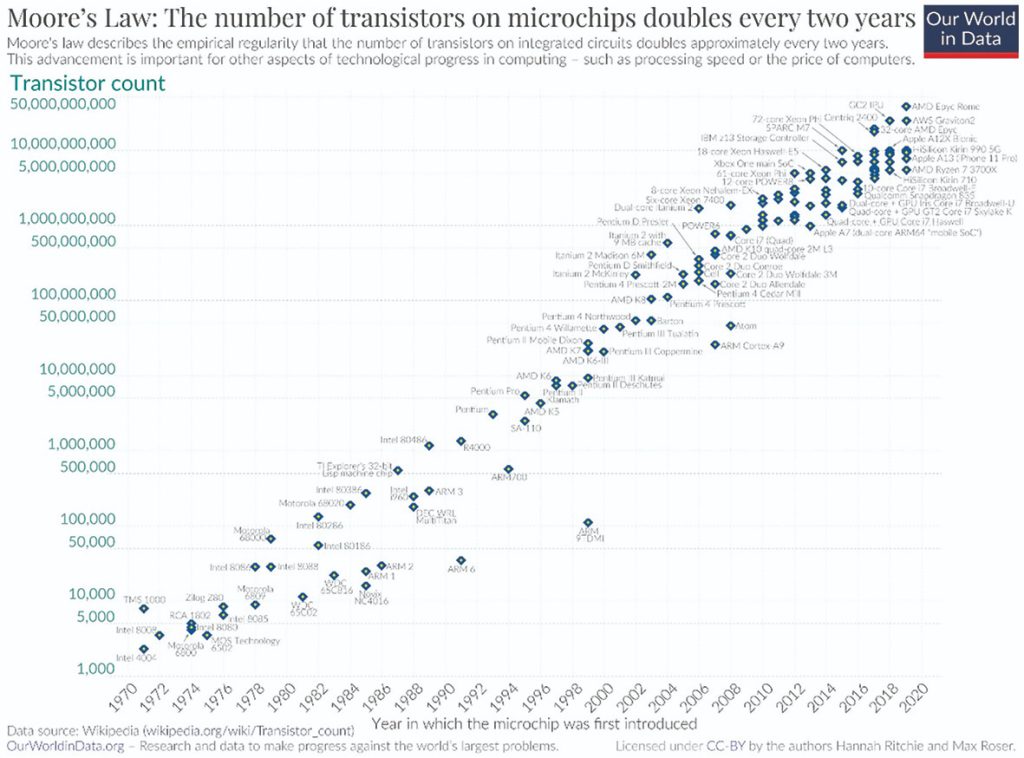
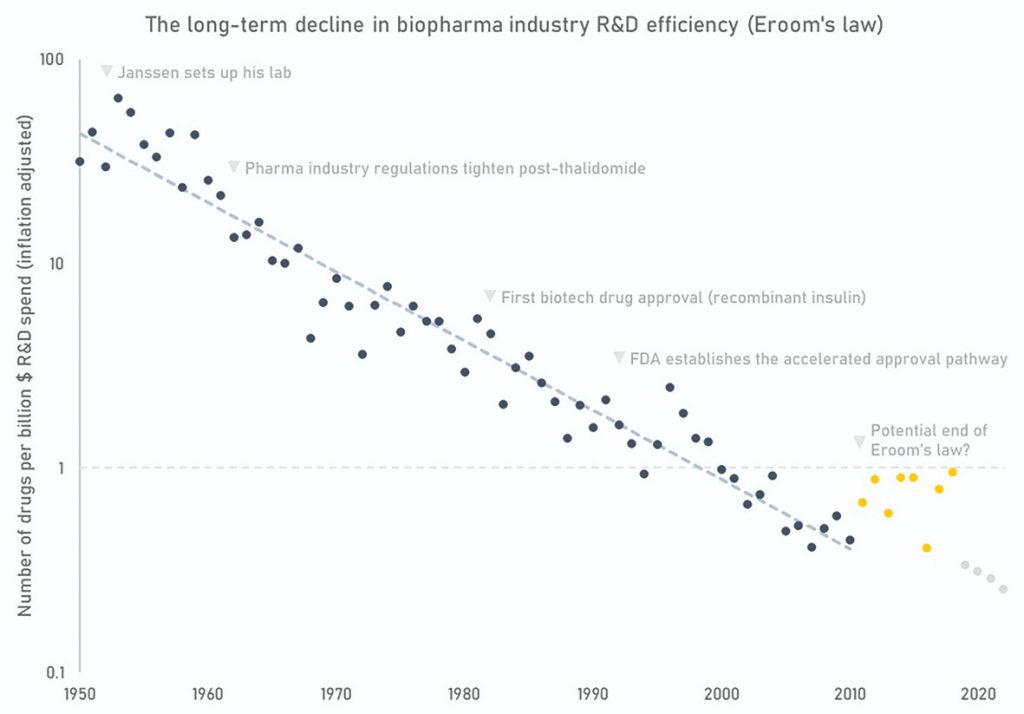
گوردون مور در سال ۱۹۶۵ پیشبینی کرد که تعداد ترانزیستورها در هر مدار مجتمع هر دو سال یکبار دو برابر خواهد شد و صنعت کامپیوتر به این پیشبینی عمل کرد. جک اسکَنل در سال ۲۰۱۲ به طور معروف پیشبینی کرد که تعداد داروها بهازای هر یکمیلیارد دلار کاهش دو برابری در هر ۹سال خواهد داشت. متاسفانه، صنعت درمانی ما تا حد زیادی این پیشبینی را دنبال کرده است .
چرا این اتفاق افتاده است؟
قانون اروم دربرگیرنده چندین چالش نوظهور در صنعت مثل افزایش هزینههای تحقیق و توسعه و کاهش نرخ موفقیت هر برنامه دارویی است. هزینههای روبه افزایش تحقیق و توسعه منشأهای متعددی دارند. سهم قابلتوجهی از این موضوع احتمالا ریشه در بیماری هزینه بامول دارد. این پدیده در کل اقتصاد دیده میشود اما ظاهرا مشکلات ویژه در توسعه دارو بیشتر ناشی از نرخ بالای شکست در داروهای کاندیداست. نرخ موفقیت برنامههای دارویی نیز به همان اندازه پیچیده است. شکستها میتوانند به دلیل مشکلات ایمنی، عدم دستیابی دارو به هدف زیستی مورد نظر، یا انتخاب نامناسب هدف برای یک بیماری خاص رخ دهند. تعیین مقادیر دقیق برای هر یک از این انواع شکستها چالشبرانگیز است زیرا اکثریت دادههای مربوط به چرخه زندگی دارو در شرکتهای دارویی محفوظ باقی ماندهاند. با این حال، میتوانیم شکستها را به دو دسته کلی تقسیم کنیم: ایمنی و اثربخشی و با استفاده از برآوردهای آگاهانه به تحلیل بپردازیم.
شکستهای ایمنی حدود ۲۰، ۳۰درصد از تمام کاندیداها: مولکول ساخته میشود اما در بیماران ناامن تشخیص داده میشود. اینگونه شکستها معمولا در فاز یک آزمایشها مشخص میشوند.
شکستهای اثربخشی ۷۰، ۸۰درصد از همه کاندیداها: بقیه کاندیداهایی که شکست میخورند –یعنی حدود ۶۳درصد از کل داروهایی که وارد آزمایش میشوند – به دلیل عدم اثربخشی شکست میخورند. اگرچه دارو ایمن است اما بیماری را درمان نمیکند. از همین اعداد کلی مشخص است که بالاترین نقطه اثرگذاری در فرآیند توسعه دارو، افزایش نرخ اثربخشی داروهای جدید است. این موضوع در نتایج آزمایشهای بالینی هم قابل مشاهده است. بخش اعظم داروها در فاز۲ شکست میخورند یعنی اولین مرحلهای که اثربخشی اندازهگیری میشود و اولین آزمون این فرضیه که آیا کنترل هدف زیستی تعیین شده واقعا برای بیماران مفید است یا خیر.
در مقابل برخی گفتارهای تکراری در اکوسیستم صنعت دارویی که میگویند بار مقرراتی بیش از حد در بازار آمریکا (با سهم بیش از ۵۰درصد درآمد جهانی) بزرگترین مانع توسعه داروهاست، اگر این ادعا درست بود، باید شاهد داروهای فوقالعادهای باشیم که فقط در خارج از آمریکا و در بازارهایی با مقررات سادهتر عرضه شدهاند اما غیبت این داروها نشان میدهد که تغییر صرفا مقرراتی کافی نیست، ولو اینکه بتواند روند را تسریع کند. در واقع، چالشهای اصلی ما علمی هستند: ما واقعا نمیدانیم چگونه داروهای موثری بسازیم که سلامت را حفظ یا بیماری را معکوس کنند! اگر میخواهیم داروهای بیشتری داشته باشیم، باید بفهمیم چرا آنها کار نمیکنند و این مشکلات را حل کنیم.
چرا داروهای کاندیدای ما موثر نیستند؟
شکستهای اثربخشی به طور کلی میتوانند به دو دلیل عمده رخ دهند:
- شکست در تعامل: ما زیستهدف درستی را برای مداخله انتخاب کردهایم اما داروی کاندیدا نتوانسته به شکل موثری آن را دستکاری کند. این نوع شکست بیشترین شباهت را به یک مشکل مهندسی دارد.
- شکست در انتخاب هدف: داروی کاندیدا دقیقا همانطور که انتظار میرفت، هدف زیستی انتخاب شده را دستکاری کرده است اما متاسفانه آن هدف، اثر مورد انتظار را بر بیماری نداشته است. این نوع شکست، یک شکست علمی یا شناختی است، نه یک مشکل مهندسی. ما به سادگی زیستشناسی مربوطه را بهخوبی درک نکردهایم تا بتوانیم مداخلهای سودمند برای بیماران انجام دهیم.
تعیین فراوانی دقیق این دو نوع شکست دشوار است اما میتوان از برخی منابع استنباط کرد که شکست در انتخاب هدف، غالب است.
– نرخ موفقیت داروهای زیستمشابه که به اهداف شناخته شده حمله میکنند، بسیار بالاست (بیش از ۸۰درصد).
– داروهایی که علیه اهدافی با شواهد ژنتیکی توسعه یافتهاند، دو تا سه برابر نرخ موفقیت بالاتری نسبت به داروهایی دارند که علیه اهداف فاقد این شواهد ساخته شدهاند. این نشان میدهد که انتخاب هدفهای خوب، اهرم بزرگی برای موفقیت است .
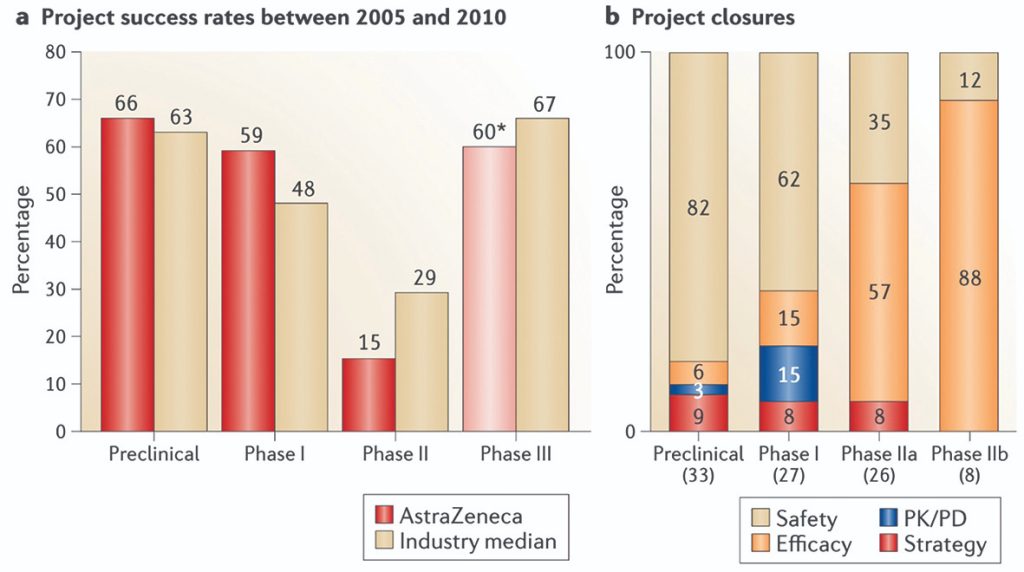
– در سازمانهایی که دادههای داخلی قابلاتکایی دارند، انتخاب هدف درست، اولویت اول در همه برنامهها محسوب میشود. به عنوان مثال، در چارچوب «۵R» شرکت آسترازنیکا، اولین اصل (هدف درست) است .
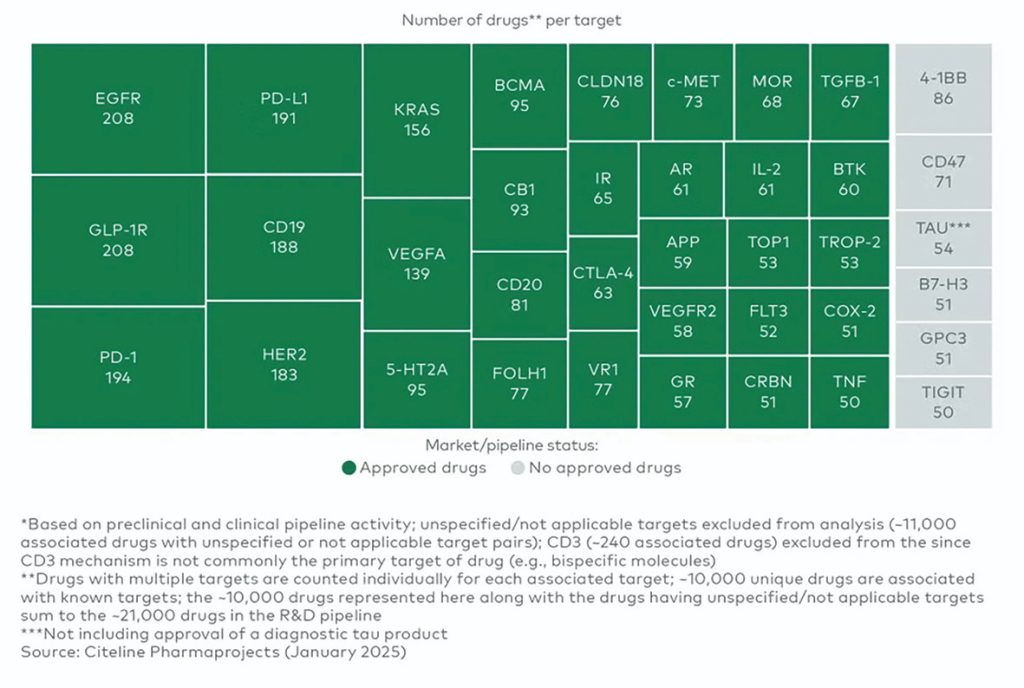
– غلبه شکستهای ناشی از هدف باعث شده که بیشتر شرکتهایی که روی روشهای نوین کار میکنند، تنها روی مجموعهای محدود از اهداف با زیستشناسی بهخوبی اعتبارسنجی شده تمرکز کنند. این موضوع منجر به «تراکم» دهها داروی بالقوه روی همان اهداف شده، و این روند در حال افزایش است .
تراکم روی اهداف شناختهشده شاید قویترین سیگنال یکپارچه باشد که نشان میدهد شکست در انتخاب اهداف، دلیل اصلی عدم اثربخشی داروهای ما در بالین است. بسیاری از تیمهای مختلف و بسیار هوشمند با تجمیع تمام اطلاعات موجود به این نتیجه رسیدهاند که کشف هدف آنقدر با ریسک علمی همراه است که ترجیح میدهند با پذیرش ریسکهای بازار، از آن اجتناب کنند.
آیا یافتن اهداف دارویی دشوارتر شده است؟
اگر جستوجوی اهداف، عامل محدودکننده در عملکرد تولید داروهای ما باشد، دشواری یافتن اهداف باید با گذشت زمان افزایش یابد تا بخشی از قانون اروم را توضیح دهد. چگونه ممکن است با وجود تمام پیشرفتهای علم زیستپزشکی، اینچنین باشد؟ در مقالهای تاثیرگذار با عنوان «آیا ایدهها در حال سختتر شدن برای یافتن هستند؟»، نیکلاس بلوم و همکارانش استدلال میکنند که بسیاری از حوزههای اختراع با کاهش بازدهی سرمایهگذاری مواجه هستند. به طور شهودی، میوههای کمارتفاع در یک رشته خاص زودتر چیده میشوند و برای برداشت همان میزان از شاخههای بالاتر درخت ایدهها، سرمایهگذاری بیشتری لازم است. در حوزه درمانی، میتوان مثالهای ملموسی برای توضیح این موضوع ارائه داد. در دهههای ۱۹۵۰ تا ۱۹۸۰، داروهای موفق جدید عمدتا شامل آنتیبیوتیکهای وسیعالطیف، هورمونهای جنسی مرکزی (استروژن و آنتاگونیستهای تستوسترون)، داروهای ضدویروسی برای HIV و بیولوژیکهای اولیه برای هورمونهای سیگنالدهنده مرکزی (انسولین، هورمون رشد، اریتروپویتین) بودند. این داروها از اهداف سادهتری مانند میکروبها و هورمونهای قابل اندازهگیری در خون بهره میبردند. با این حال، بیماریهای شایع امروزی پیچیدهتر هستند و بسیاری از فرضیههای درمانی ساده قبلا مورد استفاده قرار گرفتهاند.
اختراع داروهایی که با پیچیدگیهای طبیعت همخوانی داشته باشند
شتاب در کشف دارو نیازمند شناسایی موثرتر «اهداف» است. این امر نهتنها شامل بهبود فرآیندهای سنتی شناسایی هدف میشود، بلکه تغییر کلی در تعریف هدف را نیز میطلبد. امروزه ما معمولا اهداف را به عنوان یک ژن یا مولکول منفرد در نظر میگیریم که میتوانیم آن را برای دستیابی به هدف درمانی دستکاری کنیم. این تصور احتمالا نیاز به تغییر دارد تا بتوانیم به میوههای استعاری بالاتر در درخت علم دستیابیم. پیری و بیماری شامل تعامل پیچیدهای از مدارهای مولکولی هستند. بهجز بیماریهای عفونی و ژنتیکی منوژنیک، مشکلات بهداشتی کمی وجود دارند که نتیجه یک مولکول منفرد با غلظت بیش از حد یا کمبود باشند. حفظ سلامت و تقویت فیزیولوژی ما نیازمند انطباق پیچیدگی زیستی با پیچیدگی داروهای ماست. باید از فکر کردن به اهداف به عنوان مولکولهای منفرد دست برداریم و شروع به تصور فرضیههای درمانی کنیم که بر ترکیبهای ژنی، رفتارهای سلولی مهندسی شده و بازسازی بافتها تکیه دارند. این نکته بهنظر واضح میرسد. پس چرا تاکنون داروهایی به این شکل توسعه نیافتهاند؟
ریشههای اهداف معاصر ما
بیشتر اهداف کنونی ما از یک فرآیند پژوهشی تصادفی بهوجود آمدهاند. به عبارت دیگر، پژوهشگران دانشگاهی زیستشناسی یک بیماری را بررسی و سپس در نهایت مولکولی را شناسایی میکنند که برای بروز پاتولوژی لازم یا کافی است. هر یک از این مولکولها معمولا از طریق یک فرآیند شهودی پیشنهاد میشوند. به طور مشخص، یک دانشمند مینشیند و با دقت به مشکل فکر میکند، براساس شهود، آثار قبلی و دادههای جدید خود حدسی درباره بازیکنان مولکولی مسوول میزند، سپس آزمایش میکند تا ببیند آیا مولکول علتساز است یا خیر. اکثریت قریب به اتفاق این فرضیهها اشتباه هستند! تعداد کمی که درست از آب درمیآیند، اغلب به عنوان مبنای فرآیند کشف داروهای مبتنی بر هدف معاصر ما قرار میگیرند و چندین شرکت بهسرعت برنامههایی برای پیگیری آنها راهاندازی میکنند. این رویکرد اهدافی مانند PD-1، CD19، VEGFR2 و BTK را در حوزه اهداف شلوغ امروز بهوجود آورده است.با وجود موفقیتهایش، این روش چند محدودیت کلیدی دارد که توضیح میدهند چرا اهداف کنونی ما اینقدر محدود شدهاند:
– توان عملیاتی جفتهای هدف:بیماری آزمایششده بهاینصورت و کارایی از نظر دلار در هر هدف کشف شده نسبتا پایین است.
– با توجه به توان عملیاتی پایین، تقریبا غیرممکن است که فرضیههایی را آزمایش کنیم که شامل دستکاری زیستی بهشیوهای پیچیدهتر از افزایش یا کاهش یک هدف منفرد باشند. این به طور ذاتی ما را محدود میکند به کشف اهدافی که بسیار کاهش یافتهتر از زیستشناسی واقعیای هستند که امیدواریم دستکاری کنیم.
تقلیل آزمایشهای طبیعی
کمبود فضای هدف یک مشکل شناخته شده در صنعت برای دههها بوده است. بهمحض اتمام پروژه ژنوم انسانی، مطالعات ژنتیکی انسانی در مقیاس وسیع بهنظر میرسید که یک پاسخ ممکن به این مشکل ارائه دهند. هر ژنوم انسانی بیش از یکمیلیون واریانت نسبت به ژنوم مرجع نماینده دارد. این واریانتها به عنوان نوعی آزمایش طبیعی یکی از تنها منابع اطلاعاتی درباره اثر دستکاری یک ژن خاص در انسانها عمل میکنند. با در دست داشتن تعداد زیادی ژنوم انسانی همراه با سوابق پزشکی، پژوهشگران میتوانند ارتباطهایی بین واریانتهای ژنتیکی و سلامت انسان پیدا کنند. سپس میتوان واریانتها را به ژنها مرتبط کرد و پژوهشگران میتوانند اهدافی را کشف کنند که ممکن است بیماری خاصی را تشدید یا پیشگیری کنند. این رویکرد با موفقیت برخی از اهداف شلوغ در پانتئون امروز از جمله PCSK9را بهوجود آورده است. یک گروه کامل از شرکتها
(Celera، deCODE، Incyte، Millennium، Myriad) برای بهرهبرداری از این منبع جدید ایجاد شد. ممکن است در ابتدا تعجبآور باشد که چرا روشهای ژنتیکی مسیر بهرهوری تحقیق و توسعه را تغییر ندادهاند.در حالی که امیدوارکننده است، ژنتیک انسانی تنها میتواند یک کلاس خاص از اهداف را آشکار کند. هرچه اندازه اثر یک واریانت ژنتیکی بزرگتر باشد، به دلیل فشار انتخابی، کمتر در جمعیت ظاهر میشود. در واقع، این بدان معناست که بزرگترین اثرات در زیستشناسی کمترین احتمال کشف را با استفاده از ژنتیک انسانی دارند. بسیاری از بهترین اهداف شناخته شده به همین دلیل سیگنال ژنتیکی کمی دارند. روشهای کنونی ما در کشف ژنهای منفردی که با سلامت ارتباط دارند، خوب عمل میکنند، اما کشف ترکیبهای ژنی در بهترین حالت نوپاست. ژنتیک انسانی نمیتواند به ما کمک کند تا داروهای ترکیبی یا مدارهای ژنی را برای نصب در یک درمان سلولی کشف کنیم. از نظر جامعهشناختی، کشف اهداف دارویی با ژنتیک انسانی بهنوعی به یک نظر اجماعی تبدیل شده است. بیشتر شرکتهای بزرگ کشف دارو تیمهایی اختصاصی برای این رویکرد دارند. این به مشکل تراکم کمک کرده است، به طوری که بسیاری از شرکتها به همان مجموعه از اهداف درون محدودیتهای کشف ژنتیکی پرداختهاند. این داروها قطعا میتوانند تاثیرگذار باشند اما به نظر میرسد که به علاوه ۱۰ دارو هدفگیری PCSK9 تخصیص منابع بهینهای برای بیماران نباشد.
ساخت سیستمهای کشف دارو
آیا ممکن است فرآیند کشف دارو را بهگونهای ساختارمندتر و با محدودیتهای کمتر طراحی کنیم؟ آیا میتوانیم زیستشناسی اهداف دارویی را با پیچیدگیای مشابه با منشأ بیماریها کشف کنیم؟ دو انقلاب فناوری در این زمینه پاسخ مثبت میدهند. روشهای ژنومیک عملکردی است که اکنون به ما این امکان را میدهند که فرضیات بیشتری را نسبت به گذشته آزمایش کنیم. از دادههای حاصل، مدلهای هوش مصنوعی میتوانند فضاهای فرضی بسیار بزرگ، مانند فضا مدارهای ژنی یا درمانهای ترکیبی را جستوجو کنند. با انجام بیشتر آزمایشها در دنیای بیتها به جای اتمها، میتوان به سوالاتی پاسخ داد که برای نسل قبلی دانشمندان دست نیافتنی بود. ژنومیک عملکردی از فناوریهای توالییابی (خواندن) و سنتز (نوشتن) DNA برای موازیسازی آزمایشها در سطح سلولها و مولکولها استفاده میکند. به جای انجام هر آزمایش در یک لوله آزمایش منحصربهفرد برای پیگیری شرایط، جزئیات آزمایشی در جفتهای پایه DNA درون یک سلول یا مولکول کدگذاری میشوند و سپس با توالییابی خوانده میشوند. در عمل، این امکان را به پژوهشگران میدهد که سلول را به عنوان واحد آزمایش در نظر بگیرند و از این طریق توان عملیاتی بسیاری از سوالات کشف هدف را ۱۰۰ تا ۱۰۰۰ برابر افزایش دهند. این روشها برای هر مشکل کشف هدف قابل اعمال نیستند (مثلا برخی پاتولوژیها تنها در سیستمهای بافتی ظاهر میشوند) اما با این حال، یک کلاس از مداخلات احتمالی را که قبلا بیش از حد برای جستوجو موثر بودند، باز میکنند. این روشها را میتوان به عنوان روشی برای انجام آزمایشهای «اختلالی» سنتی که به ما میآموزند سیستمهای زیستی چگونه کار میکنند، با مزایای چندگانهسازی توالییابی DNA در نظر گرفت. هزینه توالییابی DNA با گذشت زمان کاهش مییابد ، بنابراین این امر به توانایی ما در کشف زیستشناسی هدفهای جدید برای درمانها کمک میکند. این تنها یکی از راههایی است که حل مشکلات مهندسی میتواند پیشرفت در مشکلات علمی متمایز و چالشبرانگیز صنعت ما را تسریع کند.
حتی با بهترین روشهای تجربی ممکن، برخی از زیستشناسیهای هدف دارویی امیدوارکننده هرگز به طور کامل جستوجو نخواهند شد. تعداد تقریبا نامحدودی از مداخلات ژنتیکی ترکیبی وجود دارد که ممکن است دارو شوند، مدارهای مصنوعی که ممکن است به سلولها مهندسی شوند و تغییراتی در ترکیب بافت که ممکن است ایجاد کنیم. مدلهای هوش مصنوعی میتوانند مدلهای عمومی را از دادههای تولید شده در آزمایشهای ژنومیک عملکردی از انواع مختلف یاد بگیرند و نتایج آزمایشهایی را که هنوز انجام ندادهایم، پیشبینی کنند. اگر موفق شویم مدلی کارآمد برای یک کلاس خاص از زیستشناسیهای هدف بسازیم، ممکن است بتوانیم کارآیی کشف هدف را به طور قابلتوجهی افزایش دهیم. هزینه کشف یک هدف میتواند بیش از یکمیلیارد دلار به کمتر از یک میلیون دلار کاهش یابد.
علاقه فزایندهای به ایده ترکیب این فناوریها برای ساخت «سلولهای مجازی» وجود دارد، مدلهایی که میتوانند نتایج آزمایشهای کشف هدف را بهصورت درون سیلیکویی پیشبینی کنند پیش از آنکه در آزمایشگاه اجرا شوند. نسخه بزرگ این چشمانداز شامل تمام زیستشناسیهای هدف ممکن است، از مهار ژنها تا درمانهای مولکولهای کوچک چنددارویی. در شکل حداکثری، ممکن است سالها طول بکشد تا محقق شود. با این حال، تحققهای محدودتر در حال حاضر قابل دسترس هستند. نسخههای اولیه این مدلها در حال ظهور در شرکتهای پیشبینی زیستی اولیه هستند. به عنوان مثال، Recursion در حال ساخت مدلهایی از اختلالات ژنتیکی در سلولهای سرطانی است، Tahoe Tx در حال ساخت مدلهایی در آنکولوژی با رویکرد زیستشناسی شیمیایی است و NewLimit مدلهایی برای برنامهریزی مجدد سن سلول در انواع سلولهای انسانی توسعه داده است. مدلهای متمرکز مانند اینها نشاندهنده یک نمایش اولیه هستند که این رویکرد عمومی میتواند ارزش درمانی ایجاد کند. این فناوریها تنها در ۵ تا ۱۰ سال گذشته ظهور کردهاند. این ممکن است از دیدگاه آکادمیک اخبار قدیمی به نظر برسد اما چرخههای کشف دارو در حدود یک دهه هستند. ما اکنون تنها شروع به برداشت اولین محصول از این رویکرد کردهایم. ما شروع به دیدن اولین داروهایی کردهایم که زیستشناسیهای هدف در حال ظهور را در بالین درمان میکنند، از جمله وضعیتهای سلولی پیچیده و مداخلات ترکیبی اسید نوکلئیک. امیدوارم که توانایی ما در کشف این زیستشناسیهای پیچیده هدف با مهارت تازهیافتهمان در داروسازی آنها مطابقت داشته باشد.
دوران فراوانی اهداف
در این دوران، شواهد موجود به طور قانعکنندهای نشان میدهند که کشف اهداف درمانی، عامل محدودکننده اصلی در توسعه داروهای مدرن است. فناوریهای نوین فرصتی را فراهم میکنند تا منحنی قانون «اروم» را معکوس کرده و به سوی پیشرفت حرکت کنیم. ما پتانسیل ورود به آیندهای را داریم که در آن اهداف درمانی دیگر محدودکننده سرعت توسعه دارو نخواهند بود.
چگونه باید منابع را در راستای این فرصت تخصیص دهیم؟
علم و کشف درمانها با منابع عمومی (~۵۰ میلیارد دلار در سال، NIH و NSF ایالاتمتحده)، خیریهها (۲-۱میلیارد دلار در سال) و سرمایهگذاری خصوصی (~۵-۱۰میلیارد دلار در سال، سرمایهگذاری ریسکپذیر و عرضه عمومی اولیه) پیش میروند. از این میان، تامین مالی عمومی بهدلیل مقیاس عظیم، احتمالا بزرگترین عامل محرک است. موسسات علمی خیریهای (مانند Arc، Broad وCZI) گامهای اولیه را برای پیشبرد این آینده ممکن برداشتهاند. هر دو Arc و CZI ابتکارات بزرگی را برای ساخت مدلهایی مناسب برای کشف اهداف درمانی در مقیاس بزرگ اعلام کردهاند و Broad اخیرا یک مرکز هوش مصنوعی راهاندازی کرده است که ممکن است پیشرفت مشابهی را ایجاد کند. کشف درمانی از سرمایهگذاری عمومی پیروی میکند. این امر نیازمند آن است که موسساتی مانند NIH پروژههای بزرگتری با رویکرد تیمی و حمایت یکپارچهتری از محققان علوم کامپیوتر نسبت به طرحهای سنتی «یک محقق، یکR01» که در آژانس غالب است، تامین مالی کنند.سرمایهگذاری خصوصی شروع به شرطبندی روی این نظریه کرده است اما اکثریت منابع هنوز بر روی پیگیری اهداف شناخته شده متمرکز است. حتی در مرز شرکتهایی که از هوش مصنوعی استفاده میکنند (شرکتهای تکنولوژی زیستی، اگر اجازه دهید)، بخش زیادی از سرمایه بر طراحی مولکولهای جدید برای این اهداف قدیمی متمرکز است. این احتمالا ناشی از این واقعیت است که در حالی که مهندسی درمانی ارزش مورد انتظار کمتری نسبت به پیگیری اهداف جدید دارد، همچنین نوسان کمتری دارد و استخرهای بزرگتری از سرمایه برای شرطهای کمنوسان و کمارزش مورد انتظار در دسترس است تا شرطهای پرنوسان و پرارزش مورد انتظار. شرکتهای بیوتکنولوژی اغلب دههها طول میکشد تا سودآور شوند. اگر شما معتقد هستید که آینده سلامت انسان در خارج از دنیای محدود اهداف شناخته شده است، تخصیص منابع بیشتر به سمت آن آینده در حال ظهور منطقی است، حتی اگر باور داشته باشید که این آینده زمان میبرد تا تحقق یابد.
جمعبندی
قانون «اروم» همچنان به عنوان یک مانع بزرگ در صنعت بیوتکنولوژی باقی مانده است. بسیاری آن را به عنوان یک نیروی گرانشی- امری ثابت و مقاوم در برابر درک بنیادین- غیرقابل تغییر پذیرفتهاند اما در واقع، اینگونه نیست. کاهش بهرهوری در تحقیق و توسعه در دهههای اخیر عمدتا ناشی از محدودیت در درک زیستی ماست، نه فقدان عنصری نادر و ضروری از سطح زمین یا مانعی غیرقابل نفوذ در مقررات. صنعت ما اغلب در برابر این احساس افول اجتنابناپذیر، واکنش نشان داده است و تلاش کرده از ریسک دوری کند. بهجای یادگیری پرسیدن سؤالات علمی بهتر، اغلب از طرح سؤالاتی که پاسخ آنها هنوز مشخص نیست، اجتناب کردهایم. این امر منجر به ظهور صدها درمان متمایز شده است که در تلاش برای هدفگیری همان گروه کوچک از زیستشناسیها هستند. بهنظر میرسد که این تخصیص منابع، حداکثرسازی تعداد سالهای سالمی که به جهان ارائه میدهیم، نباشد.ما وارد عصری از هوش فراوان میشویم. با این ابزارها، فرصت داریم تا زیستشناسیهای هدف را با سرعتی کشف و طراحی کنیم که هزینه آن قابل اندازهگیری نباشد. درمانهایی که از این روند ظهور میکنند، میتوانند به عنوان ضدمثالی عمل کنند که قانون اروم را به یک گمانهزنی تاریخی تقلیل میدهد. اگر این امر تحقق یابد، احیای سرعت کشف درمانی ما احتمالا باارزشترین دستاورد انقلاب هوش مصنوعی خواهد بود که اکنون در حال شکلگیری است. هیچ محصولی باارزشتر از زمان سالم وجود ندارد.
توضیح نمودار: گزارش اخیر شرکت مشاورهای LEK نشان میدهد که این روند چقدر برجسته شده است. حتی اگر کسی صرفا به صفحات خط تولید شرکتهای بیوتکنولوژی نگاه کند، بهراحتی میتواند ببیند که این پدیده واقعا وجود دارد.
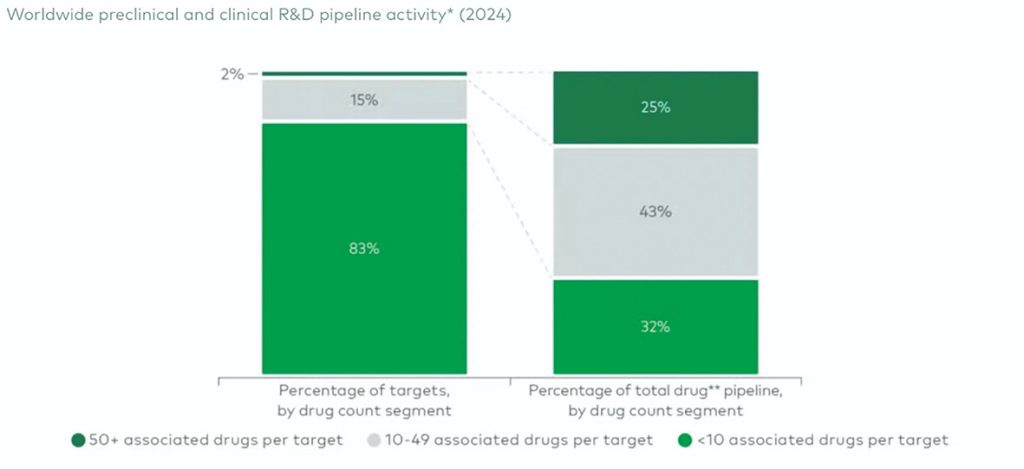
توضیح نمودار: در گزارش مشاورهای L.E.K. با عنوان «آیا بیوفارما به اندازه کافی در پیشبرد اهداف نوآورانه تلاش میکند؟» آمده است که: «اهداف جدید درمانی، زیرمجموعهای کوچک از دستهبندی «سبز روشن» هستند (کمتر از ۱۰ دارو مرتبط با هر هدف) که حدود ۳۲درصد از داروهای در دست توسعه را تشکیل میدهند.»


